LEYES DE LA TERMODINAMICA
- CyRE CURSOS Y REGULARIZACIÓN ESTUDIANTIL
- 29 jul
- 4 Min. de lectura
Ley Cero de la Termodinámica
Si dos sistemas están en equilibrio térmico con un tercero, entonces están en equilibrio térmico entre sí.
Ejemplo cotidiano:
Cuando usas un termómetro para medir tu temperatura corporal, en realidad estás confiando en la ley cero: si el termómetro y tu cuerpo están en equilibrio térmico, el termómetro indica tu temperatura.
PRIMERA LEY DE LA TERMODINAMICA (LEY DE LA CONSERVACION DE LA ENRGIA TERMICA)

TIPOS DE PROCESOS

NOTA
en algunas ocasiones la primera ley tambien se escribe

NOTA IMPORTANTE PARA LOS CAMBIOS DE SIGNO

EJEMPLOS


EJERCICIOS
1.
Un gas absorbe 500 J de calor y realiza un trabajo de 200 J. ¿Cuál es el cambio en su energía interna?
2.
Un sistema recibe 700 J de calor y su energía interna aumenta en 400 J. ¿Qué cantidad de trabajo realizó el sistema?
3.
Un sistema realiza un trabajo de 350 J y su energía interna disminuye en 150 J. ¿Cuánto calor recibió o perdió?
4.
Un gas se comprime y recibe 100 J de trabajo desde el exterior. Su energía interna aumenta en 250 J. ¿Qué cantidad de calor absorbió?
5.
Un sistema pierde 300 J de calor y su energía interna disminuye en 500 J. ¿Cuánto trabajo realizó el sistema?
6.
Un sistema realiza 120 J de trabajo y recibe 80 J de calor. ¿Cuál es el cambio en su energía interna?
7.
Un sistema realiza un trabajo de 400 J y no recibe ni pierde calor. ¿Cuál es el cambio en su energía interna?
8.
Un gas pierde 200 J de calor y al mismo tiempo se le realiza un trabajo de 100 J. ¿Cuál es el cambio en su energía interna?
9.
La energía interna de un sistema aumentó 180 J, y se sabe que realizó un trabajo de 80 J. ¿Cuánto calor recibió?
10.
Un sistema es comprimido y no cambia su energía interna. Si se le aplicaron 300 J de trabajo desde el exterior, ¿cuánto calor perdió o ganó?
RESULTADOS

SEGUNDA LEY DE LA TERMODINAMICA
"En cualquier proceso termodinámico espontáneo, la entropía del universo tiende a aumentar."
🔎 ¿Qué significa?
La entropía es una medida del desorden o del número de formas en que se puede organizar la energía en un sistema.
Esta ley nos dice que:
La energía útil para realizar trabajo disminuye con cada transformación.
Los procesos naturales tienen una dirección preferida, generalmente del orden al desorden.
Es imposible construir una máquina térmica que convierta todo el calor en trabajo sin pérdidas.
📌 Ejemplos de la vida diaria:
Taza de café caliente en la mesa El calor del café se disipa en el ambiente. El calor fluye naturalmente del objeto más caliente al más frío, no al revés.
Hielo derritiéndose El agua sólida (ordenada) se transforma en agua líquida (menos ordenada). La entropía aumenta.
Motor de coche Solo una parte de la energía de la gasolina se convierte en movimiento. El resto se disipa en forma de calor. Nunca se aprovecha el 100%.
Forma alternativa de la ley (Kelvin-Planck):
"Es imposible construir una máquina térmica que, operando en un ciclo, convierta todo el calor absorbido en trabajo."

EJEMPLO

LEYES DE LOS GASES

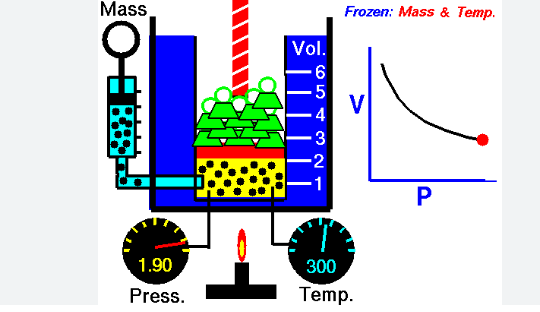



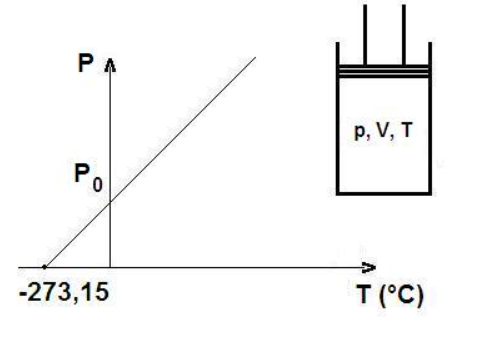




EJERCICIOS
1. (Boyle – presión y volumen a T constante)
Un gas ocupa 5.0 L a 1.2 atm. ¿Cuál será su volumen si la presión aumenta a 3.0 atm, manteniendo la temperatura constante?
2. (Charles – volumen y temperatura a P constante)
Un gas tiene un volumen de 3.0 L a 273 K. ¿Qué volumen tendrá a 546 K si la presión se mantiene constante?
3. (Gay-Lussac – presión y temperatura a V constante)
Un gas tiene una presión de 1.0 atm a 300 K. ¿Qué presión tendrá si se calienta a 450 K y el volumen no cambia?
4. (Boyle)
A temperatura constante, un gas a 2.0 atm ocupa 8.0 L. ¿Cuál será su presión si se comprime a 4.0 L?
5. (Charles)
Un gas ocupa 1.5 L a 200 K. ¿Cuál será su volumen a 400 K manteniendo constante la presión?
6. (Gay-Lussac)
Un gas tiene una presión de 4.0 atm a 250 K. Si se enfría a 125 K a volumen constante, ¿cuál será su nueva presión?
7. (Ley General del Estado Gaseoso)
Un gas tiene un volumen de 2.0 L a 1.0 atm y 300 K. ¿Cuál será su volumen si la presión cambia a 2.0 atm y la temperatura a 600 K?
8. (Boyle)
Un gas a temperatura constante tiene un volumen inicial de 10.0 L y una presión de 0.8 atm. ¿Cuál será la presión si el volumen disminuye a 2.0 L?
9. (Charles)
El volumen de un gas es 2.5 L a 250 K. ¿A qué temperatura estará el gas si su volumen se incrementa a 5.0 L a presión constante?
10. (Ley General del Estado Gaseoso)
Un gas ocupa 6.0 L a 1.2 atm y 350 K. ¿Qué volumen ocupará si se lleva a 2.4 atm y 700 K?
RESPUESTAS






Comentarios