GAS IDEAL
- CyRE CURSOS Y REGULARIZACIÓN ESTUDIANTIL
- 29 jul
- 2 Min. de lectura
La Ley del Gas Ideal describe el comportamiento de un gas en función de su presión, volumen, temperatura y cantidad de sustancia, asumiendo que el gas se comporta de manera ideal (sin interacción entre moléculas y con volumen despreciable).
PV=nRT
Símbolo | Significado | Unidad (SI) |
P | Presión del gas | atm (o Pa, dependiendo del R usado) |
V | Volumen del gas | Litros (L) o metros cúbicos (m³) |
n | Número de moles de gas | mol |
R | Constante universal de los gases | 0.082 Latm/ mol K |
T | Temperatura absoluta | Kelvin (K) |
La ecuación indica que:
Si aumentas la temperatura de un gas (en Kelvin), sus moléculas se mueven más rápido, aumentando la presión (si el volumen es constante) o el volumen (si la presión es constante).
Si aumentas la cantidad de moles nnn, el gas ocupa más volumen (si la presión y la temperatura se mantienen constantes).
🎓 Condiciones para que un gas se comporte idealmente:
Presión baja
Temperatura alta
Moléculas pequeñas y no polares
En estas condiciones, las partículas tienen pocas interacciones entre sí, y se comportan de forma ideal.
EJEMPLO
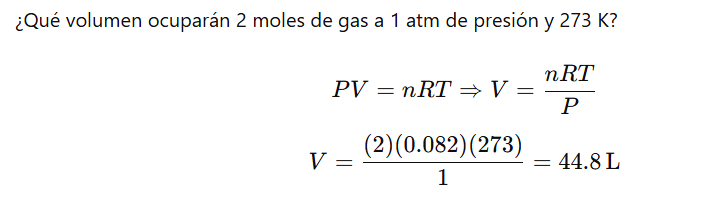
¿Qué presión ejerce 1.5 moles de un gas que ocupa 10.0 litros a una temperatura de 300 K?



EJERCICIOS
Ejercicio 1: Calcular volumen
¿Qué volumen ocuparán 3 moles de un gas ideal a una temperatura de 273 K y una presión de 1 atm?
🔹 Ejercicio 2: Calcular presión
Se tienen 0.8 moles de un gas que ocupan 18 litros a 300 K. ¿Qué presión ejerce el gas?
🔹 Ejercicio 3: Calcular temperatura
Un gas ocupa 10 L a una presión de 1.5 atm y contiene 0.5 moles. ¿Cuál es su temperatura?
🔹 Ejercicio 4: Calcular número de moles
Un gas ocupa 24.6 L a 298 K con una presión de 1 atm. ¿Cuántos moles contiene?
🔹 Ejercicio 5: Condiciones no estándar
¿Qué volumen ocupa 2.5 moles de gas a una temperatura de 350 K y una presión de 2 atm?
RESPUESTAS






Comentarios